Los humanos necesitamos oxígeno molecular (O 2) para respirar, y el espacio está esencialmente desprovisto de él. Así que para explorar el espacio, necesitamos nuestro propio suministro de oxígeno. Sin embargo, aún en las atmósferas más densas, el O 2 es escaso. Recientemente, investigadores han demostrado una nueva reacción para generar oxígeno que podría ayudar a los humanos a explorar el universo y quizás incluso a combatir el cambio climático en casa.
El oxígeno molecular puede encontrarse fuera de la Tierra en la estela de gas que sale de los cometas. La fuente de ese oxígeno había sido un misterio hasta hace dos años, cuando Konstantinos P. Giapis, profesor de ingeniería química en Caltech, y su compañero postdoctoral Yunxi Yao, propusieron la existencia de un nuevo proceso químico que podría explicar su producción.
Ahora, Giapis junto al químico Tom Miller han demostrado una nueva reacción para generar oxígeno que representa un nuevo tipo de química descubierta al estudiar los cometas.
La mayoría de las reacciones químicas requieren energía, que normalmente se proporciona como calor. Pero la investigación de Giapis demuestra que algunas reacciones se pueden producir por energía cinética.
Es decir, cuando las moléculas de agua se disparan como balas extremadamente pequeñas en superficies que contienen oxígeno, como arena u óxido, la molécula de agua puede arrancar ese oxígeno para producir oxígeno molecular. Es un tipo de reacción que ocurre en los cometas, cuando las moléculas de agua se evaporan de la superficie y luego son aceleradas por el viento solar hasta que chocan contra el cometa a gran velocidad.
Por otro lado, los cometas también emiten dióxido de carbono (CO 2). En ese sentido, Giapis y Yao querían probar si el CO 2 también podría producir oxígeno molecular en colisiones con la superficie del cometa.
Y cuando encontraron el oxígeno molecular en la corriente de gases del planeta, querían comprobar si la reacción era la misma que la que ocurre en el agua. Así que diseñaron un experimento que consistía en hacer que el CO 2 se estrellara sobre la superficie inerte de una lámina de oro, que al no poder oxidarse no debería producir O 2.
Y sin embargo, el oxígeno molecular continuó siendo emitido desde la superficie de la lámina. Por tanto, ambos átomos de oxígeno provienen de de misma molécula de CO 2..
“En ese momento pensamos que sería imposible combinar los dos átomos de oxígeno de una molécula de CO 2 juntos porque el CO 2 es una molécula lineal, y tendrías que doblar la molécula severamente para que funcione”, dice Giapis. “Estás haciendo algo realmente drástico a la molécula”.
Los expertos califican estos procesos como una “química inusual”. “Para nuestra sorpresa”, dijo Meller, “el estado de excitación no creó oxígeno molecular. En cambio, la molécula se descompuso en otros productos. En última instancia, encontramos que también se puede formar un CO 2 muy doblado sin excitar la molécula, y eso podría producir O 2“.
El aparato diseñado por Giapis para realizar la reacción funciona como un acelerador de partículas, convirtiendo las moléculas de CO 2 en iones, dándoles una carga y luego acelerándolas usando un campo eléctrico, aunque con energías mucho más bajas que las que se encuentran en un acelerador de partículas.
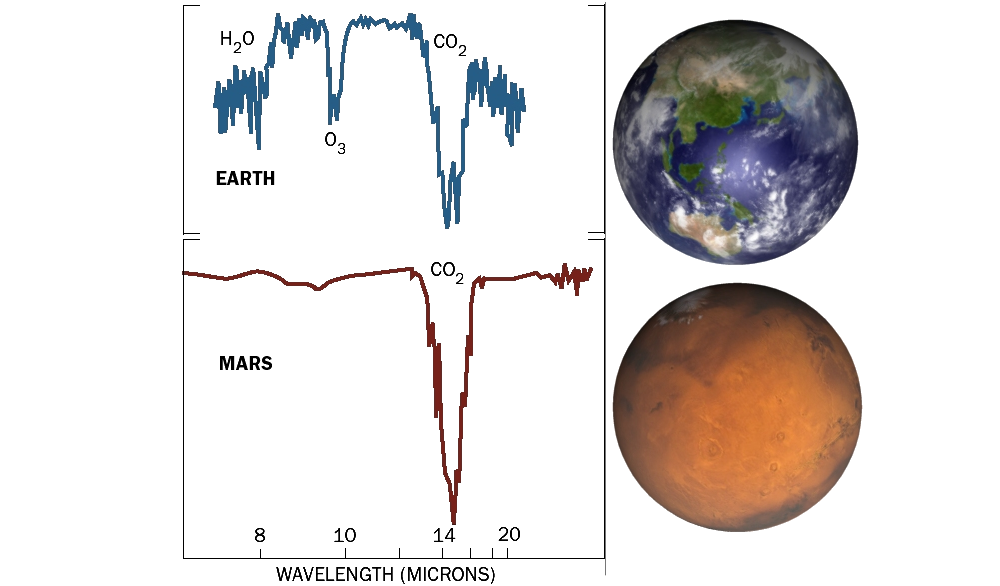
Pero el dispositivo no es esencial para que ocurran estas reacciones, pues así es como se explica la presencia de pequeñas cantidades de oxígeno en la superficie de Marte.
Tal vez algún día esta química inusual sirva para generar aire respirable para los astronautas en Marte o ser utilizada para combatir el cambio climático tomando los gases de efecto invernadero fuera de la atmósfera terrestre y convirtiéndolos en oxígeno.